“Prosessi 2” – Pfizerin aiemmin salainen toinen tutkimus osoittaa, että hyväksyntä koski täysin erilaista rokotetta
5 min read
Pikalinkki tähän artikkeliin: https://publication-x.com/o6f1
Vaihtoehtoisen median kansainväliset toimittajat tutkivat niin sanottujen Covid-19-rokotteiden tarkkaa kehittämis-, testaus- ja jakeluprosessia. Nyt on tapahtunut toinen läpimurto, joka muuttaa virallisen tarinan täysin: Pfizerin hyväksyntätutkimukseen kuuluva niin kutsuttu “Process 2” oli hyvin pidetty salaisuus viime aikoihin asti. Asiakirjat osoittavat, että ympäri maailmaa jaettavat rokotteet on valmistettu erilaisella, paljon vaarallisemmalla ja ongelmallisemmalla valmistusmenetelmällä kuin hyväksytty.
Lähde: Report24.news
Prosessi 2:n johtolankoja piilotettiin koko ajan Pfizerin COVID-rokotteen kliinisessä tutkimuksessa. War Roomin ja DailyCloutin toimittajien havainnot ovat sekä musertavia että järkyttäviä. Yhdysvaltain elintarvike- ja lääkevirasto (FDA) tiesi, että haitalliset sivuvaikutukset olivat hyvin yleisiä prosessin 2 koehenkilöillä, mutta ei ole näyttöä siitä, että virasto olisi toiminut näiden hälyttävien havaintojen perusteella.
Prosessi 2:ksi kutsuttua “tutkimusta tutkimuksessa” ei ole vielä löydetty kymmenistä tuhansista Pfizer-asiakirjoista, jotka FDA joutui julkaisemaan tuomioistuimen päätöksen vuoksi. DailyClout-tiimit tarkastelivat Ph.D Josh Guetzkowin asiantuntijalausuntoja. Tel Avivin heprealaisesta yliopistosta, jota käytettiin oikeusjutussa Yhdistyneessä kuningaskunnassa, ja alkoi etsiä todisteita niiden 250 koehenkilön olemassaolosta ja myöhempiä tutkimustietoja, jotka saattoivat osallistua kokeeseen Euroopan lääkeviraston (EMA) puolesta oli osallistunut.
War Room/DailyClout -vapaaehtoinen, apteekkihenkilöstö Erika Delph, huomasi poikkeaman satunnaistusluvuissa, jotka vastaavat tämän liitteenä olevan “tutkimuksen sisällä” olevan numeron ja päivämäärän kanssa. Dataanalyytikot ja lääketieteen asiantuntijat analysoivat nämä tiedot. Se, mitä he löysivät, on järkyttävää: 502 koehenkilöä osallistui Pfizerin COVID-rokotteen “kokeeseen kokeessa”, ja heille annettiin lääkettä, joka oli kontaminoitunut liian korkeilla DNA-plasmideilla. Tätä voidaan yrittää pitää huolimattomuudesta tai onnettomuudesta. Asiakirjojen muistiinpanoista kuitenkin käy ilmi, että se oli tahallista ja että Pfizer tiesi, että se antoi 252 epäonniselle koehenkilölle täysin erilaisen ruiskeen kuin se, johon he olivat ilmoittautuneet. Pelkästään tämä tosiasia on vastoin vuoden 1947 Nürnbergin lakia, jonka mukaan ihmiskokeiden suorittaminen ilman suostumusta on laitonta yksityiskohtaisten ja täydellisten tietojen jälkeen.
Mikä on prosessi 2 ja miksi tämä meteli?
Pfizer mainitsi termit “Prosessi 1” ja “Prosessi 2” tämän maailmanlaajuisesti käytettäväksi tarkoitetun uuden lääkealustan kliinisen tutkimusprotokollan eri iteraatioissa. “Prosessi” viittaa tapaan, jolla “rokote” tuotettiin.
Pfizerin kliinisen COVID-rokotteen BNT162b2:n alkuperäisessä valmistusprosessissa käytettiin lähetti-RNA-replikaatio (amplifikaatio) -tekniikkaa, joka tunnetaan nimellä PCR (polymeraasiketjureaktio). Se toimii pohjimmiltaan kuin kopiokone, jossa alkuperäinen mRNA replikoidaan/kloonataan. Tätä kutsutaan “prosessiksi 1”.
Kaupallisesti tällainen prosessi on kallis ja sitä olisi parannettava merkittävästi, jotta saataisiin riittävä määrä annoksia koko maailmalle. Tuotteen skaalaamiseksi kaupallisesti käytettiin todistettua massatuotantomenetelmää, E. Coli -bakteeria. Tämä massatuotantotekniikka on “prosessi 2”. Hankala ongelma oli, että “Prosessi 2” käytti täysin erilaista valmistusprosessia kuin kliinisen tutkimuksen (prosessi 1) tuotteessa, ja hätäkäyttölupa (EUA) “rokotteelle” myönnettiin prosessin 1 perusteella. Lisäksi prosessi 2 ei noudattanut määrättyä Good Manufacturing Practice (GMP) -käytäntöä, johon Pfizerin ja maiden tai EU:n väliset sopimukset perustuvat. Huomioi kansalliset sopimukset Pfizerin kanssa, jotka raportoivat24vuotanut aikaisin .
Kevin McKernanin menetelmällä 2 tekemien pullojen jäännöstuotteen geneettisen sekvensoinnin tulokset vahvistavat muiden ryhmien raportit, joiden mukaan modifioidussa mRNA:ssa on merkittävää kontaminaatiota korkeilla DNA-plasmidifragmenttien tasoilla.
Tämä saastuminen johtuu E. Colin käytöstä valmistuksen aikana. Näitä bakteereja esiintyy luonnollisesti ihmisen suolistofloorassa ja ne ovat yleinen keino mRNA-sekvenssien massatuotantoon. Tarvittava geeni insertoidaan DNA-renkaaseen ja bakteerit replikoivat näitä plasmideja jatkuvasti.
Tällä menetelmällä tuotetut plasmidit puhdistetaan käyttämällä entsyymejä (DNAaasi), ja niillä on säädelty yläraja lopputuotteessa, koska teoreettiset huolenaiheet tämän DNA:n sisällyttämisestä ihmisisäntägenomiin ovat olemassa.
Vaikka prosessin 2 aktiivinen ainesosa oli identtinen prosessin 1 kanssa, Euroopan lääkevirasto (EMA) oli havainnut DNA-plasmidien aiheuttaman kontaminaatiotason ja oli huolestunut, koska se ylitti selvästi aiemmin julkaistut turvallisuustasot. EMA oli niin huolissaan, että se pyysi Pfizeria ja FDA:ta integroimaan uuden menettelyn noin 250 koehenkilön kliinisen tutkimuksen loppuun mennessä.
Mitä aiemmin piilotettuja tietoja War Room/DailyClout -tutkijat löysivät?
He tunnistivat ainutlaatuisen kohortin poikkeavien satunnaistuslukujen perusteella, joilla ei ollut mitään järkeä verrattuna kliinisen tutkimuksen pääosassa käytettyihin sekvensseihin. He tunnistivat myös poikkeavat eränumerot, jotka sisältävät prosessissa 2 kehitettyjä tuotteita. Näitä 502 koehenkilöä testattiin neljässä paikassa Yhdysvalloissa, joista 250 oli lumelääkettä ja loput 252 saivat Process 2 -tuotteen.

Tuotteella oli ainutlaatuinen toimittajan eränumero “ EE8493Z ”, joka on tunnistettu Pfizerin erä-/eräluetteloasiakirjassa ( https://www.phmpt.org/wp-content/uploads/2022/06/125742_S1_M5_5351_c4591001-interim-mth6-patient .pdf ).
Kohortti erotettiin myös koehenkilöistä, jotka saivat prosessin 1, ja tutkimuksen sokkoutumattomasta osasta EUA:n myöntämisen jälkeen, jossa käytännössä koko plaseboryhmä päätutkimuksesta sai “rokotteen”.
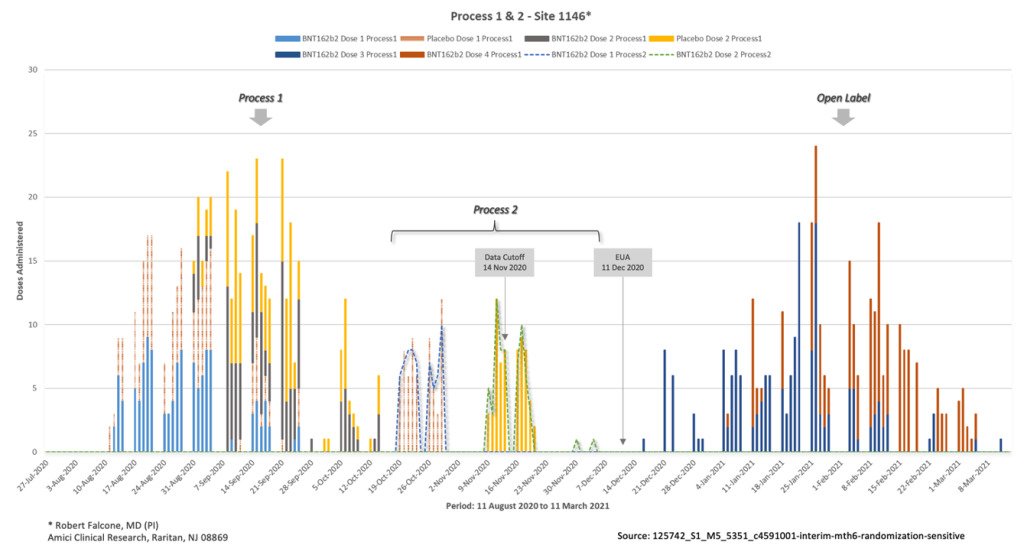
Kun lähennät Process 2 -tietoja, kohteiden erottelu on helpompi nähdä.
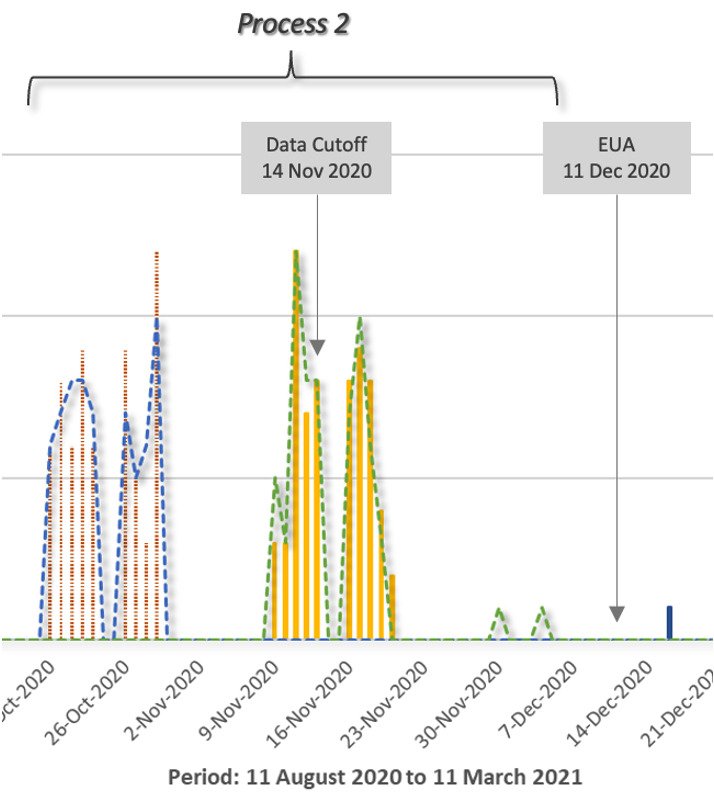
Haittatapahtumien määrässä oli merkittävä ero prosessin 2 koehenkilöiden ryhmässä. Tämän olisi pitänyt herättää hälytyskelloja sääntelijöiden keskuudessa, koska tulokset olivat paljon huolestuttavampia kuin aikaisemmissa kliinisissä tutkimuksissa (prosessi 1) esiintyneet merkittävät haittavaikutukset (AE).
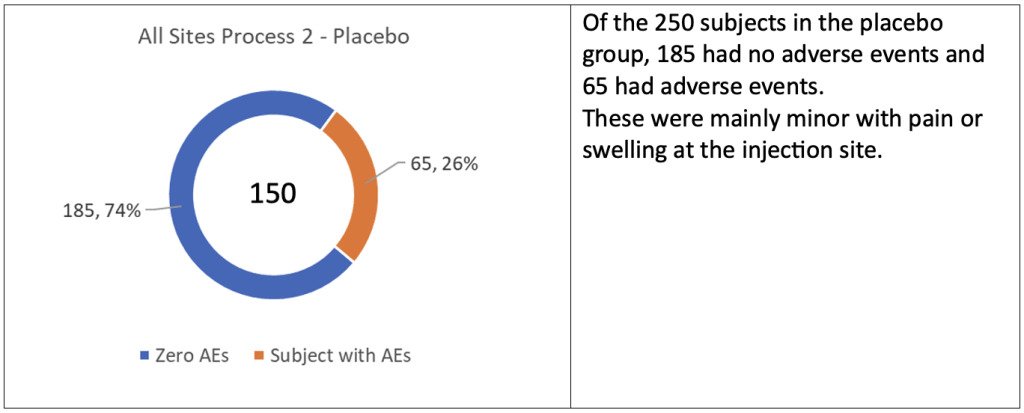
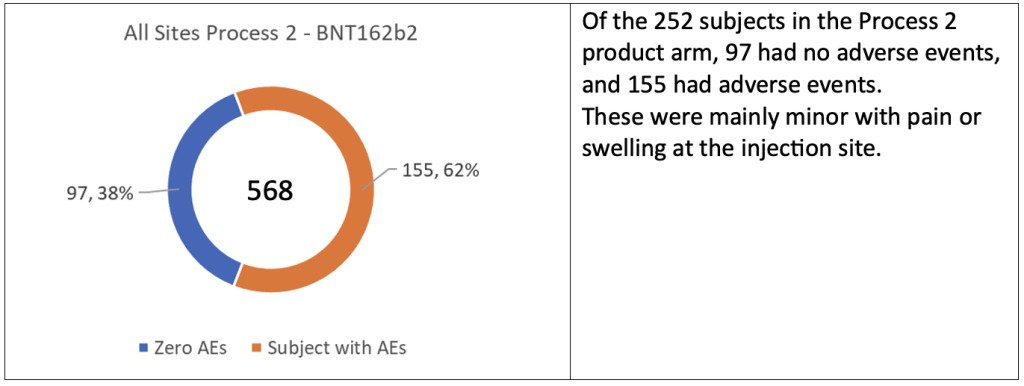
Vaikka sivuvaikutukset olivat “vähäisiä”, lumelääkettä saaneiden ja hoitoryhmien välillä oli suuri ero, 65 vs. 155 eli 2,4 kertaa enemmän. Siksi olisi odotettu lisätutkimuksia syyn selvittämiseksi, koska tämä oli uusi menettely, jonka tavoitteena oli yleinen käyttöönotto.
Mitä uutta ja huolestuttavaa löydöissä on?
Euroopasta saadut raportit perustuivat todistajanlausuntoihin EJ0553:n “hätäerästä”, jota käytettiin 11 koehenkilössä neljässä muussa kuin kliinisen minitutkimuksen paikassa (paikat 1001, 1002, 1003 ja 1007). Pfizerin eränumeroasiakirjassa “Prosessi 2” -tuotteella on myös nimitys “Z”, jota on saatettu käyttää uudella prosessilla valmistetun tuotteen tunnistamiseen. USA:ssa ei saa käyttää maan ulkopuolella valmistettuja tuotteita. Mutta Australian sääntelyviranomaiselta, Therapeutic Goods Administrationilta (TGA) on todisteita asiakirjassa ( FOI 3659 Document 4) otsikolla ”BNT162b2 (PF-07302048) Vertailuraportti PPQ:n lääketuoteeriin” – tämän mukaan erä EJ0553Z valmistettiin Puursissa Belgiassa ja luovutettiin ”hätätarvikkeena”.
Uudet havainnot rokotteista ja prosessista 2 perustuvat empiiriseen näyttöön, joka on jo julkaistu Pfizerin asiakirjoissa .
Tämän seurauksena erilaiset sivuvaikutusprofiilit osoittivat, että Prosessi 2 -tuote oli erilainen kuin Prosessi 1 -tuote. Tämän turvallisuussignaalin perusteella FDA:n olisi pitänyt ottaa huomioon ja päättää, että kliininen tutkimus oli toistettava, koska se oli eri tuote, jolla on erilainen turvallisuusprofiili.
Johtopäätökset
Prosessista 2 olisi pitänyt tehdä erillinen kliininen tutkimus, koska kliinisen tutkimuksen lopussa ennen EUA-hyväksyntää testattujen koehenkilöiden pienestä määrästä syntyi merkittäviä turvallisuussignaaleja. DNA-plasmidifragmenteilla havaittu kontaminaatio ylitti EMA:n salliman maksimiarvon moninkertaisesti.
Pfizerin asiakirjoista löytyvät tiedot osoittavat, että ylimääräiseen “tutkimukseen tutkimuksessa” kuuluneet 502 koehenkilöä osoittivat vahvan turvallisuussignaalin, koska haitallisia sivuvaikutuksia oli enemmän.
Testattua ja hyväksyttyä prosessia ei koskaan julkistettu ja asetettu maailman väestön saataville. Sen sijaan yleisö sai vain DNA-plasmideilla kontaminoituneen prosessin 2 tuotteen.
Jos nämä väitteet voidaan todistaa oikeudessa Daily Cloutin ja War Roomin todisteiden perusteella, tämä muuttaisi kaiken – koska maailmanlaajuisesti annetuilla rokotteilla ei ole hyväksyntää missään – kyseessä olisi tahallinen yleisön pettäminen .
Lähde: Report24.news